肝内胆管癌(ICC)预后较差,与肝内胆管结石有关,细菌在ICC的发生发展中起重要作用,其中E. coli E. coli 与ICC恶性进展的相互作用,以及ICC细胞中SGs组装的机制进行探究。
2024年2月17日,福建医科大学陈实副教授团队在 Advanced Science 上发表了题为 Escherichia coli-Induced cGLIS3-Mediated Stress Granules Activate the NF-κB Pathway to Promote Intrahepatic Cholangiocarcinoma Progression 研究论文,本研究通过构建体外和体内ICC模型以及患者源性类器官(PDOs),表明 E. coli 诱导一种新的RNA cirglis3 (cGLIS3)的产生,促进肿瘤生长,同时揭示了ICA与GP化疗联合使用可作为ICC一种有效治疗策略。
研究团队使用伯桢生物的肝内胆管癌试剂盒 Cholangiocarcinoma Organoid Kit(Serum-free) (货号:K2104-LB) 成功构建肝内胆管癌类器官。通过构建来自肝内胆管细胞癌(ICC)患者的癌细胞类器官模型,作者主要验证了ICA(阿可拉定)在ICC治疗中的作用以及ICA与GP(吉西他滨加顺铂)联合治疗的效果。在本研究中,类器官作为个性化癌症治疗模型在药效检测方面发挥了重要作用。
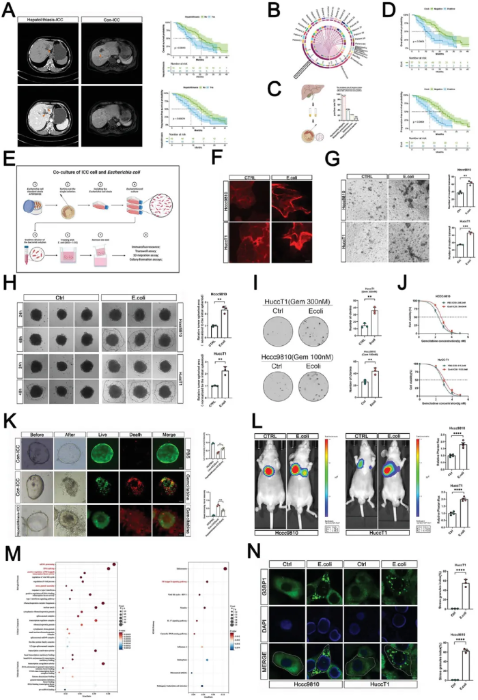
临床数据分析表明,伴有肝内胆管结石的ICC患者预后较差,E. coli 在肝内胆管结石相关ICC患者的胆汁中比例最高,且E. coli 阳性的ICC患者总体生存期和无进展生存期较差。作者通过建立大肠杆菌和 ICC 的体外间接共培养模型,观察这种环境对肿瘤进展的影响。F-肌动蛋白染色结果显示,共培养组中的ICC细胞表现出更具侵袭性的表型,通过Transwell 和 3D 迁移测定表明其增强了迁移能力,并且对吉西他滨的耐药性增加。同样地,作者使用构建的患者来源类器官(PDO)模型,也发现同时患有 ICC 和肝内胆管结石的患者来源的 PDO 对吉西他滨表现出更强的耐药性。结果证明,E. coli 促进ICC细胞的侵袭、迁移、对吉西他滨的耐药性。体内实验证实,E. coli 刺激的ICC细胞具有更强的转移能力。RNA-seq分析表明,E. coli 刺激导致ICC细胞中NF-κB等经典炎症通路富集,RNA加工相关基因富集,SGs组装增加。(图1)
图1 E. coli 促进ICC进展和SGs组装
E. coli 促进ICC进展是通过上调cGLIS3环化和SGs形成
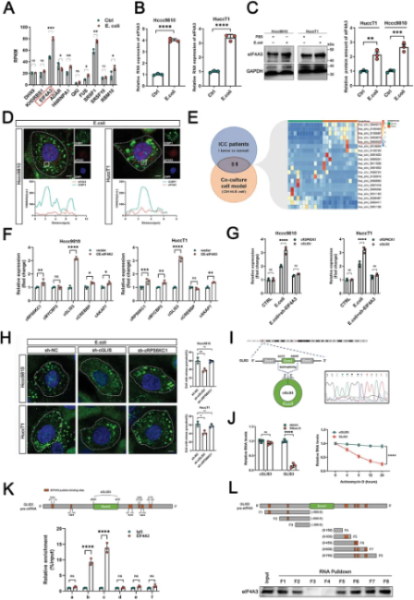
E. coli 处理后,ICC细胞中剪接因子eIF4A3的mRNA和蛋白表达显著改变。据文献报道,eIF4A3可促进并维持SG的稳定性,且与circRNA的环化有关。通过对ICC患者组织和共培养的ICC细胞进行RNA-seq,筛选出20个差异表达的circRNAs,进一步RT-qPCR实验结果证明,只有cRSPKC6和cGLIS3在eIF4A3过表达和大肠杆菌刺激后表现出差异变化。IF结果显示,敲低cGLIS3减少了由大肠杆菌诱导的SGs数量的增加,这表明大肠杆菌可能通过上调eIF4A3的表达,进而增加cGLIS3的环化来促进SGs的形成。作者通过设计收敛和发散引物来扩增GLIS3 RNA的典型和反向剪接异构体,再通过PCR以及使用发散引物的Sanger测序确认了头尾剪接位点,核糖核酸酶R抗性分析证实了cGLIS3是由人类基因组9号染色体上GLIS3的外显子2环化产生。随后,作者通过RNA免疫沉淀(RIP)实验明确cGLIS3与eIF4A3相互作用关系,并证实eIF4A3可以结合到cGLIS3前体mRNA外显子的两侧,促进环状化。接下来,通过体外实验证明,cGLIS3过表达进一步增强了E. coli 预处理后ICC细胞的迁移能力以及对吉西他滨的耐药性,而敲低则产生相反的效果。体内实验也证实,过表达cGLIS3的ICC细胞转移能力更强。综上所述,E. coli 可通过上调eIF4A3的表达介导cGLIS3的反向剪接,从而促进SG的形成,最终影响 ICC 的迁移和耐药性。(图2)
图2 E. coli 通过上调cGLIS3的环化促进SGs形成
cGLIS3/hnRNPA1/G3BP1复合物通过SGs促进ICC进展
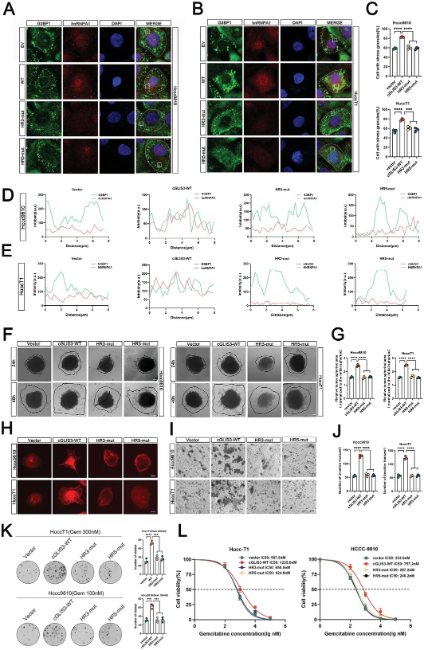
作者使用生物素标记的cGLIS3正义和反义探针在Hccc9810和HuccT1细胞中进行cGLIS3-RNA下拉实验,细胞质谱分析以及RIP实验结果证实了hnRNPA1/G3BP1与cGLIS3之间的结合。随后作者通过RNA pull-down、RIP和免疫荧光实验,确定了cGLIS3与hnRNPA1/G3BP1结合的关键环(HR3和HR5),以及hnRNPA1和G3BP1与circGLIS3相互作用的关键区域(hnRNPA1的14-184区域和G3BP1的255-419区域)。实验结果表明,E.coli刺激后,hnRNPA1和G3BP1的蛋白表达上调,cGLIS3在转录后水平调节它们的蛋白表达。过表达cGLIS3增加了hnRNPA1和G3BP1的蛋白水平和半衰期。接下来探究cGLIS3是否参与调节hnRNPA1和G3BP1的泛素化,于是作者使用K48-Ub、Flag-G3BP1和cGLIS3探针进行外源性转染。蛋白酶体抑制剂MG132处理显著降低了cGLIS3表达细胞中hnRNPA1和G3BP1的K48泛素化,cGLIS3的敲低显著增加了Hccc9810细胞中K48泛素化的Flag-G3BP1的积累。结果证实,cGLIS3通过抑制K48相关的多泛素化来稳定hnRNPA1和G3BP1。作者构建cGLIS3-HR3-MUT和cGLIS3-HR5-MUT细胞,研究结果表明,cGLIS3-HR3-MUT和cGLIS3-HR5-MUT不促进SGs形成,也不能稳定hnRNPA1和G3BP1在SGs中的结合,且它们在促进ICC进展方面的作用也丧失。综上所述,cGLIS3抑制K48相关的多泛素化,稳定了cGLIS3/hnRNPA1/G3BP1多元复合物,从而稳定SGs并促进ICC进展。(图3)
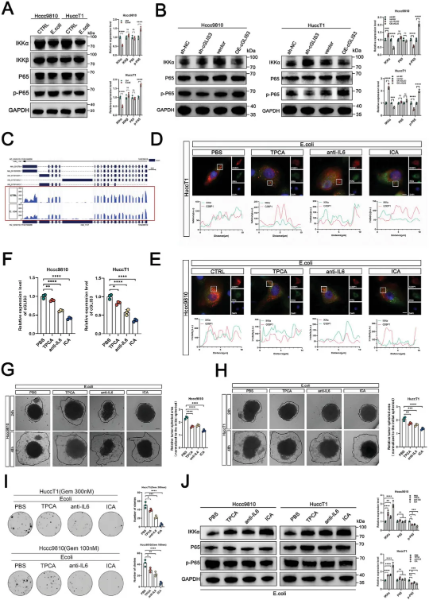
图3 cGLIS3/hnRNPA1/G3BP1复合物通过SGs促进ICC进展 作者通过测序结果观察到,伴有肝内胆管结石的ICC患者与NF-κB通路的激活具有相关性。沉默cGLIS3后NF-κB通路抑制因子IKKα蛋白表达上调,过表达后则下调,且E. coli 对IKKα在转录水平没有调节作用。RNC测序分析表明,SGs可能主要影响IKKα mRNA的翻译。免疫荧光实验显示,ICA对SGs形成的抑制作用显著,且能降低cGLIS3水平,同时降低了Hccc9810细胞被E. coli 刺激或cGLIS3过表达增强的迁移能力和耐药性。综上所述,当cGLIS3过表达时,SGs阻断了IKKα mRNA的翻译,导致NF-κB通路持续激活,从而促进ICC的侵袭、迁移和化疗耐药。(图4)
图4 SGs通过激活NF-κB信号通路促进ICC进展
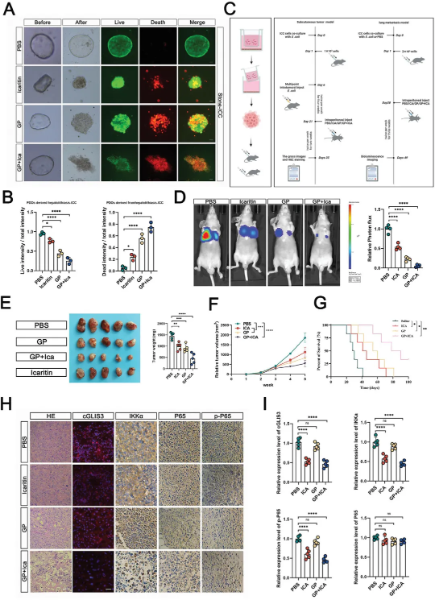
为了研究cGLIS3在体内的作用,作者首先使用从患有肝内胆管结石的ICC患者身上获取的癌细胞构建了类器官模型,并且使用钙黄绿素-AM(绿)和EthD-1(红)染料对活/死细胞进行活力定量测定,证实ICA联合GP显著增强了对癌细胞的杀伤效果。裸鼠皮下模型和肺转移模型中验证了ICA的效果,GP-ICA组均显示出最高的抗肿瘤效果。并且在皮下模型中发现GP-ICA通过有效地沉默cGLIS3而增加了IKKα水平的程度,从而降低了NF-κB通路。这些发现为患有肝内胆管结石的ICC患者的进展提供了一种新的分子机制,并证明了ICA在这一特定患者群体中的关键作用。(图5)
图5 ICA与GP联合有效抑制ICC进展
E. coli 通过上调剪接因子eIF4A3的表达,促进SGs的组装,导致NF-κB通路的持续激活,增强ICC的恶性程度。通过构建包括患者来源类器官(PDOs)在内的体外和体内 ICC 模型,证明大肠杆菌通过产生circGLIS3(cGLIS3)促进了肿瘤的生长,而抑制cGLIS3的诱导性上调便是ICC有前途的诊断和治疗靶点,为circRNA在癌症中的功能重要性增添了新的维度。本研究揭示了ICC治疗的新机制和策略,即ICA与GP化疗联合使用可能是ICC的一种有前途的治疗策略。