
ICC是第二常见的原发性肝脏恶性肿瘤,具有致密的纤维化微环境和高度恶性的特点,与化疗耐药和预后差有关。肝肿瘤微环境中被转化生长因子-β1(TGFB1)激活的HSCs分泌大量的胶原蛋白和基质蛋白,在肿瘤周围形成了一个致密的物理屏障,阻碍药物渗透,并且压缩血管,导致血管塌陷,使药物递送更加困难。因此,探索有效的靶向治疗以减少纤维化是ICC治疗的新策略。circRNAs可以调节ICC细胞的增殖、转移和耐药性,从而影响ICC的进展。目前的研究主要局限于circRNAs对ICC细胞内分子通路的调节,对于circRNAs是否在ICC致密肿瘤基质的形成和维持中发挥作用知之甚少。

2023年10月3日,福建医科大学陈实教授团队在Advanced Science在线发表题为A Novel Trojan Horse Nanotherapy Strategy Targeting the cPKM-STMN1/TGFB1 Axis forEffective Treatment of Intrahepatic Cholangiocarcinoma的研究论文,本研究人员通过构建体外和体内ICC模型和患者源性类器官(PDOs),首次揭示了cPKM通过促进STMN1和TGFB1的表达,导致HSCs的异常激活、纤维化加剧和最终血管塌陷,增强了ICC的生长、转移和对紫杉醇的耐药性,并且进一步证明靶向cPKM-STMN1/TGFB1轴的特洛伊木马纳米系统是一种有前景的ICC治疗新策略。
研究团队使用伯桢生物的肝内胆管癌试剂盒Cholangiocarcinoma Organoid Kit(Serum-free)(货号:K2104-LB)成功构建肝内胆管癌类器官。通过构建来自肝内胆管细胞癌(ICC)患者的癌细胞类器官模型,作者发现si-cPKM-FA-LNPs可以有效抑制类器官的生长,且si-cPKM/PTX-FA-LNP治疗组的抑制效果更显著。在本研究中,类器官作为个性化癌症治疗模型在药效检测方面发挥了重要作用。

作者通过加权基因共表达网络分析(WGCNA),筛选出Has-circ-0036200,称为cPKM,它来源于人类PKM基因的外显子2和3的反剪接。通过设计发散引物和收敛引物进行PCR扩增及凝胶电泳实验证实其环化特征,并通过RNA荧光原位杂交(FISH)显示cPKM主要定位于细胞质。作者利用qRT-PCR进一步验证了cPKM在细胞系中的表达水平,结果显示,cPKM在ICC细胞表达均显著高于人肝内胆管上皮细胞,同时,临床数据也证实了cPKM在ICC中高表达的特性。随后作者发现cPKM高表达的ICC组织具有更明显的纤维化、更高的肌动蛋白(α-SMA)丰度以及更多的血管塌陷。此外,Kaplan-Meier生存分析显示,cPKM表达水平升高的ICC患者的总生存期(OS)和无复发生存期更短。(图1)
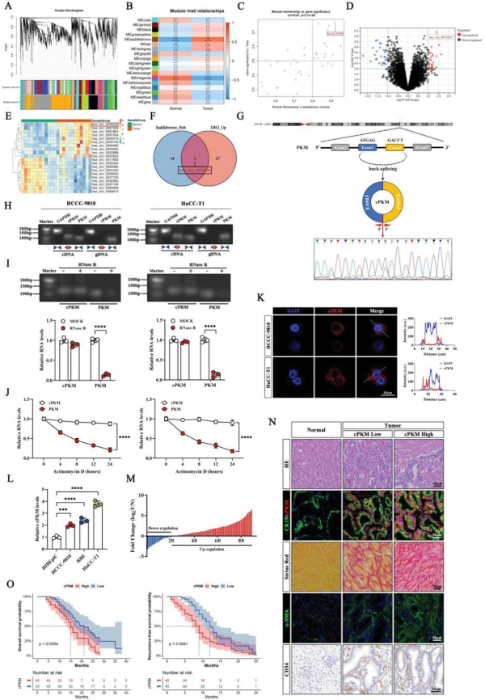 图1 ICC中circRNAs的筛选以及cPKM的特征
图1 ICC中circRNAs的筛选以及cPKM的特征
cPKM促进ICC细胞的增殖和转移,并诱导HSCs中的肌成纤维细胞活化
作者构建了针对cPKM的反向剪接位点(BSJ)的三种小干扰RNA(siRNAs)和cPKM过表达质粒来测定cPKM对3D微肿瘤球体形成和生长的影响。结果表明,cPKM过表达促进了HCCC-9810肿瘤球体的生长和迁移能力,ICC细胞中丝状伪足的形成增加,ICC细胞中N-钙粘蛋白和波形蛋白的表达上调,E-钙粘蛋白的表达受到抑制。接下来,作者建立ICC细胞和HSCs的共培养模型,验证是否高表达cPKM的ICC细胞可以促进HSCs中的肌成纤维细胞活化。IF和WB分析实验表明,高表达cPKM的ICC细胞在HSCs中诱导更多的肌成纤维细胞活化,肝星状细胞活化标志物(α-SMA、纤连蛋白和COL1A1)的表达增加。在皮下异种移植瘤和肺转移模型中,高表达cPKM同样促进了肿瘤的生长和转移。在原位移植模型中,高表达cPKM促进了ICC肿瘤在小鼠肝脏中的生长,导致更明显的纤维化、更高的α-SMA丰度和更多的血管塌陷。综上所述,cPKM促进了ICC细胞的增殖和转移,诱导HSCs中的肌成纤维细胞活化,促进了ICC肿瘤基质纤维的增殖并导致肿瘤内微血管塌陷。(图2)
 图2 cPKM表达对调节ICC细胞恶性程度的生物学效应
图2 cPKM表达对调节ICC细胞恶性程度的生物学效应
cPKM通过IGF2BP2-STMN1/TGFB1和miR-199a-5p-STMN1双轴在细胞内外发挥效应
作者通过多个数据分析以及体外实验验证得出。cPKM可以与IGF2BP2和STMN1/TGFB1 mRNA 3'UTR结合形成RNA-蛋白质复合物,并且cPKM可促进IGF2BP2与STMN1/TGFB1 mRNA之间的相互作用,从而增强了STMN1/TGFB1的mRNA稳定性。以及cPKM可以通过miR-199a-5p上调STMN1的表达,从而促进ICC细胞的增殖和迁移。总而言之,cPKM通过与IGF2BP2和miR-199a-5p相互作用上调STMN1的表达并激活AKT通路,从而促进ICC肿瘤的增殖、迁移和对紫杉醇的耐药性;cPKM通过与IGF2BP2相互作用促进ICC细胞分泌TGFB1,增强HSC肌成纤维细胞的活化。(图3)
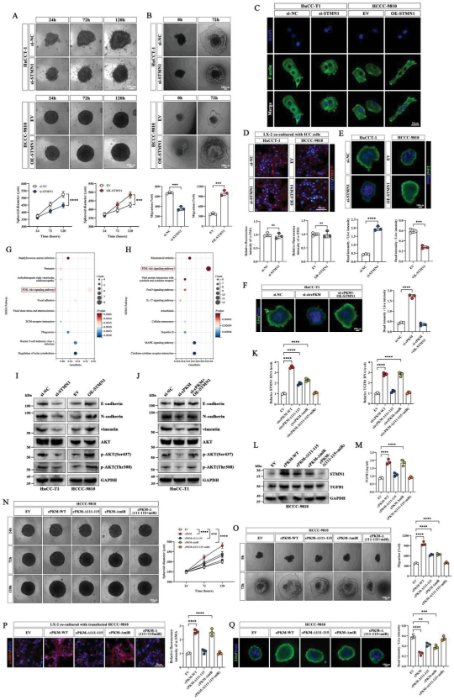 图3 cPKM通过调节STMN1和TGFB1的表达发挥效应
图3 cPKM通过调节STMN1和TGFB1的表达发挥效应
作者将脂质体成分和胆固醇溶解在乙醇中,与水性siRNA溶液混合形成脂质纳米颗粒(LNPs)。实验结果表明,纳米颗粒具有良好的稳定性,并且siRNA和PTX能有效递送到ICC细胞中。体内实验结果发现,在叶酸的辅助下,siRNA/PTX-FA-LNP处理后的皮下异种移植物中发现PTX的含量最高。由于聚乙二醇(PEG)和叶酸的效用,肿瘤细胞对纳米颗粒的摄取增加,而Kupffer细胞的摄取减少。作者构建了ICC类器官,发现si-cPKM-FA-LNPs抑制了类器官的生长,并且与游离PTX相比,si-NC/PTX-FA-LNPs的抑制效果更佳,小鼠体内ICC肿瘤模型实验结果与类器官模型一致。分子验证实验表明,si-cPKM-FA-LNPs和si-cPKM/PTX-FA-LNPs可以有效地沉默cPKM,并且能够显著降低STMN1和TGFB1的表达以及AKT的磷酸化,但是在si-cPKM/PTX-FA-LNP组中观察到Ki-67阳性细胞显著减少。LNPs的生物安全性实验数据表明纳米颗粒没有明显不良影响。在肺转移模型和原位模型中,si-cPKM/PTX-FA-LNP组显示出最佳的抗肿瘤效果。然而作者发现si-cPKM-FA-LNPs和si-cPKM/PTX-FA-LNPs降低了模型中的纤维化程度和α-SMA丰度并导致更多的微血管开放。作者还建立了HSCs和OE-cPKM HCCC-9810细胞共植入的皮下异种移植模型,si-cPKM-FA-LNP和si-cPKM/PTX-FA-LNP组表现出较少的纤维化和α-SMA丰度,较低的HIF1α水平。这些结果表明,siRNA/PTX共载纳米颗粒在多个ICC肿瘤模型中具有优越的抗肿瘤效果。(图4)
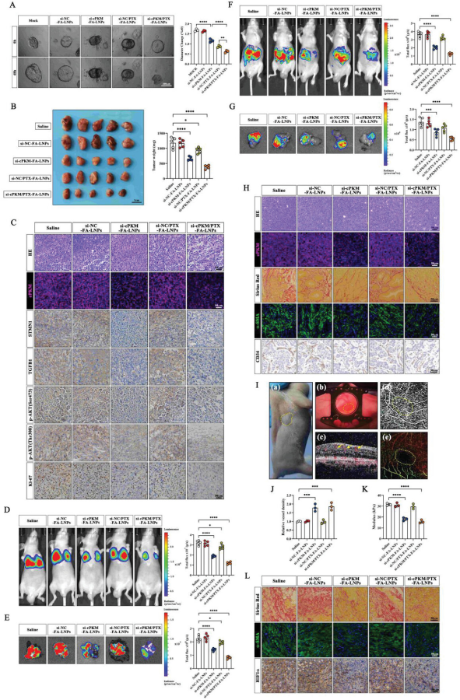 图4 siRNA和PTX共载纳米颗粒的抗肿瘤效应
图4 siRNA和PTX共载纳米颗粒的抗肿瘤效应
siRNA/PTX共载纳米颗粒增强ICC标准化疗的疗效
上述结果表明,纳米颗粒治疗抑制ICC进展,减轻ICC肿瘤基质的纤维化,开放微血管为有效的药物输送铺平了道路。为了测试siRNA/PTX共载纳米颗粒是否能增强GC治疗的疗效。作者在小鼠ICC肿瘤模型中比较了单独使用GC以及与不同治疗方法联合使用的疗效。在HSCs和OE-cPKM-ICC细胞共植入的皮下异种移植模型中,与GC单药治疗组相比,GC与si-NC/PTX-FA-LNPs的联合使用疗效有适度增加,且优于GC与游离PTX的联合使用。GC与si-cPKM/PTX-FA-LNPs的联合使用表现出最强的抗肿瘤效果。在OE-cPKM-ICC细胞的肺转移模型和原位模型中,GC与si-cPKM/PTX-FA-LNPs联合使用的抗肿瘤反应最显著。在原位模型中,si-cPKM/PTX-FA-LNP组的总生存期最长。总的来说,在多个ICC肿瘤模型中,发现siRNA/PTX共载纳米颗粒能够抑制ICC的进展,并提高标准化疗方案的疗效。(图5)
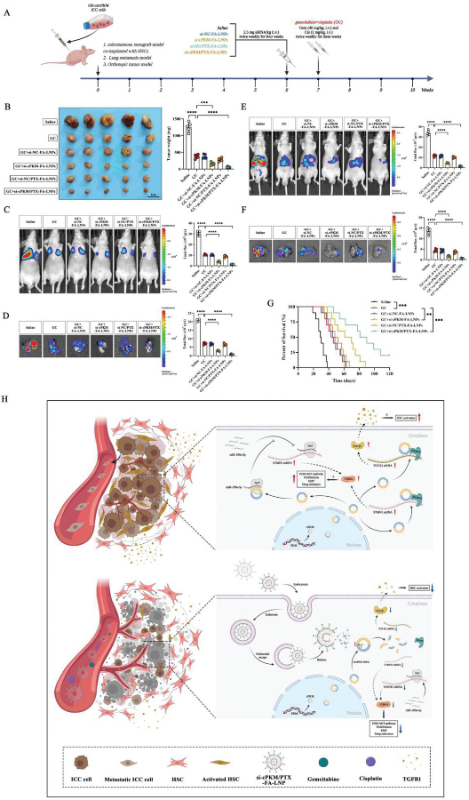 图5 siRNA和紫杉醇共载纳米颗粒增强了标准化疗方案的疗效
图5 siRNA和紫杉醇共载纳米颗粒增强了标准化疗方案的疗效
本研究发现了新的circRNA cPKM在ICC中发挥重要作用,丰富了对ICC发病机制的理解。揭示了cPKM通过促进TGFB1和STMN1表达以及导致HSCs异常活化、加剧纤维化并最终导致血管塌陷,增强ICC的生长、转移和对紫杉醇的耐药性的分子机制,包括cPKM与IGF2BP2和STMN1/TGFB1mRNA的相互作用以及作为miR-199a-5p海绵的功能。作者针对cPKM-STMN1/TGFB1轴开发了一种新型特洛伊木马纳米治疗策略,为ICC治疗提供了新的思路和方法。











