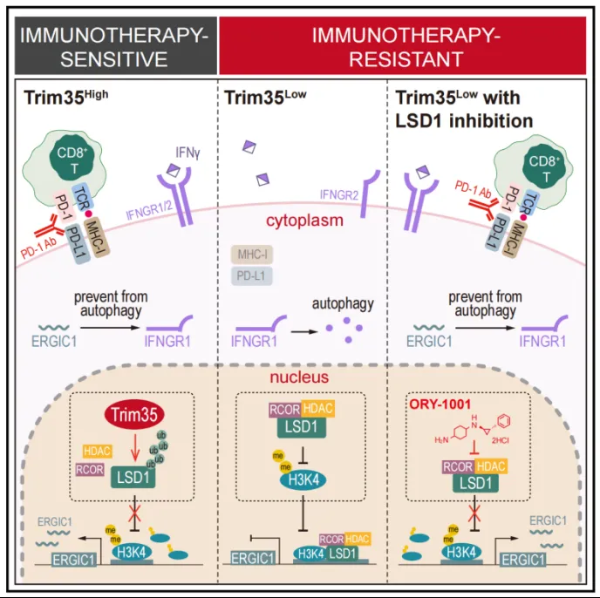
NSCLC是世界范围内导致死亡的主要原因之一,阻断免疫检查点PD-1是有效治疗NSCLC的方法。但是由于肿瘤细胞免疫原性低、T细胞功能失调等多种原因,导致大多数患者对免疫治疗没有反应。表观遗传失调是癌症的共同特征,LSD1在多种癌症中促进肿瘤的增殖和进展。但是目前缺乏可靠的生物标志物,因此限制了LSD1抑制剂在癌症治疗中的应用。三部件结构域(Trim)家族蛋白大多具有E3泛素连接酶活性,发挥着细胞内信号传导、先天免疫等各种细胞功能。然而,人们对大多数Trim蛋白的功能知之甚少。因此,本文旨在探究Trim蛋白与LSD1在免疫治疗耐药过程产生的影响,明确耐药机制,提出治疗策略,提高免疫治疗的疗效。
2023年11月17日,中南大学湘雅医院孙仑泉教授团队、翁良副研究员团队携手在Cell Reports上在线发表题为“E3 ligase Trim35 inhibits LSD1 demethylase activity through K63-linked ubiquitination and enhances anti-tumor immunity in NSCLC”的研究论文,该研究揭示了Trim35作为一个E3连接酶参与了LSD1 K63泛素化的调控,导致了对LSD1去甲基化酶活性的抑制。Trim35可以作为一个生物标志物评估LSD1的活性,并预测免疫检查点抑制疗法(ICB therapy)的预后。通过使用LSD1抑制剂,可以显著改善Trim35低表达 NSCLC的低免疫原性状态,提出了一种有前景的免疫治疗耐药肺癌的治疗策略。
该研究团队使用伯桢生物的肺腺癌类器官培养试剂盒(Lung Adenocarcinoma Organoid Kit,K2138-LA)成功构建了患者来源的非小细胞肺癌类器官模型。研究中使用两种常用的LSD1抑制剂(GSK2879552和ORY-1001)对6种NSCLC类器官进行了细胞活力检测。结果显示,Trim35表达较低的类器官对LSD1抑制剂表现出更高的敏感性。证实Trim35可作为一种生物标志物指导个体化LSD1靶向治疗。在本研究中,类器官作为个性化癌症治疗模型在机制验证和药效检测方面发挥了重要作用。

Trim35通过上调肿瘤免疫原性和T细胞浸润来抑制NSCLC的进展
作者通过分析癌症基因组图谱(TCGA)数据库NSCLC队列中Trim蛋白的变异频率,发现Trim35基因的变异频率最高(19%),并且发现在Trim35基因变异的患者中,大多数病例显示出Trim35的缺失或低表达。接下来,作者通过Trim35的亚细胞定位,发现在癌组织的细胞核内Trim35的表达较低,且核内Trim35低表达与较差的总体生存率相关。与此同时,核内Trim35低表达的肺癌组织中检测到CD8+ T细胞浸润较少。体外实验表明,Trim35蛋白功能丧失可显著促进肺癌细胞的生长和集落形成,蛋白功能的获得则抑制了癌细胞的生长。总而言之,Trim35可能通过直接抑制肺癌细胞的生长并调节肿瘤免疫微环境,在NSCLC中发挥抑癌作用。(图1)
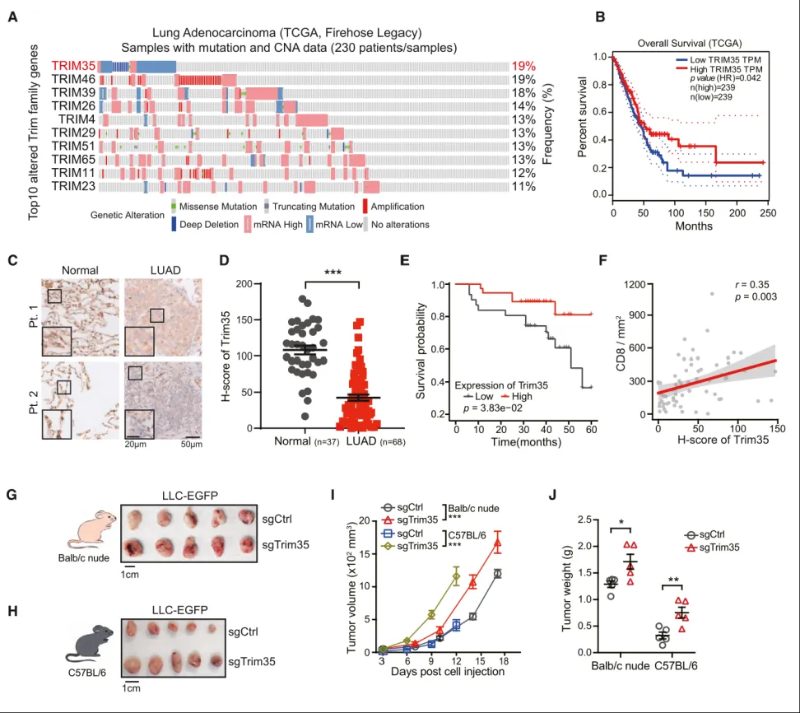 图1 Trim35低表达影响NSCLC进展
图1 Trim35低表达影响NSCLC进展
作者通过CRISPR-Cas9在小鼠肺癌LLC细胞中破坏了Trim35,并将其植入免疫缺陷小鼠(BALB/c裸鼠)和免疫活性小鼠(C57BL/6)体内。结果显示,使用Trim35敲除(KO)的裸鼠及C57BL/6小鼠均促进了体内肿瘤的进展,在注射Trim35过表达A549细胞的裸鼠中,肿瘤生长减缓,Ki67表达显著降低。此外,与Trim35 KO裸鼠相比,Trim35 KO的C57BL/6小鼠体内的肿瘤大小显著增加。这表明Trim35不仅在肿瘤增殖方面,在抗肿瘤免疫中也发挥了作用。总而言之,Trim35通过直接生长抑制和免疫调节发挥肿瘤抑制剂的作用。(图2)
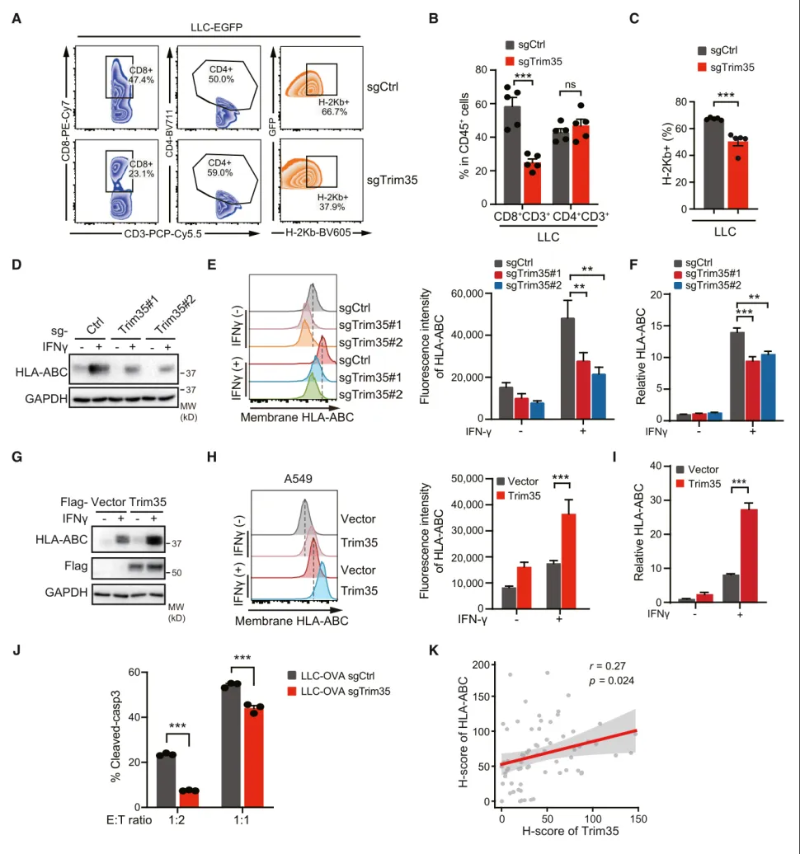 图2 Trim35在体内外均增强肿瘤免疫原性
图2 Trim35在体内外均增强肿瘤免疫原性
Trim35以LSD1为靶点进行K63连接的泛素化
作者对表达空载的A549细胞(A549- vector细胞)以及FLAG-Trim35的A549细胞(A549-Trim35细胞)进行RNA测序分析,结果显示在A549-Trim35细胞中富集到的主要生物学过程与免疫应答有关。作者利用免疫共沉淀、银染以及串联质谱分析等多种实验手段,明确LSD1与Trim35之间存在相互作用。通过免疫荧光分析和凝胶过滤的蛋白质分离发现LSD1与Trim35在细胞核内共定位,进一步说明LSD1与Trim35之间存在直接的物理联系。实验结果显示,过表达Trim35显著促进转染和内源性LSD1的泛素化,表明Trim35作为E3泛素连接酶作用于LSD1。作者通过质谱分析确定Trim35诱导了LSD1在K442位点上进行K63泛素化。(图3)
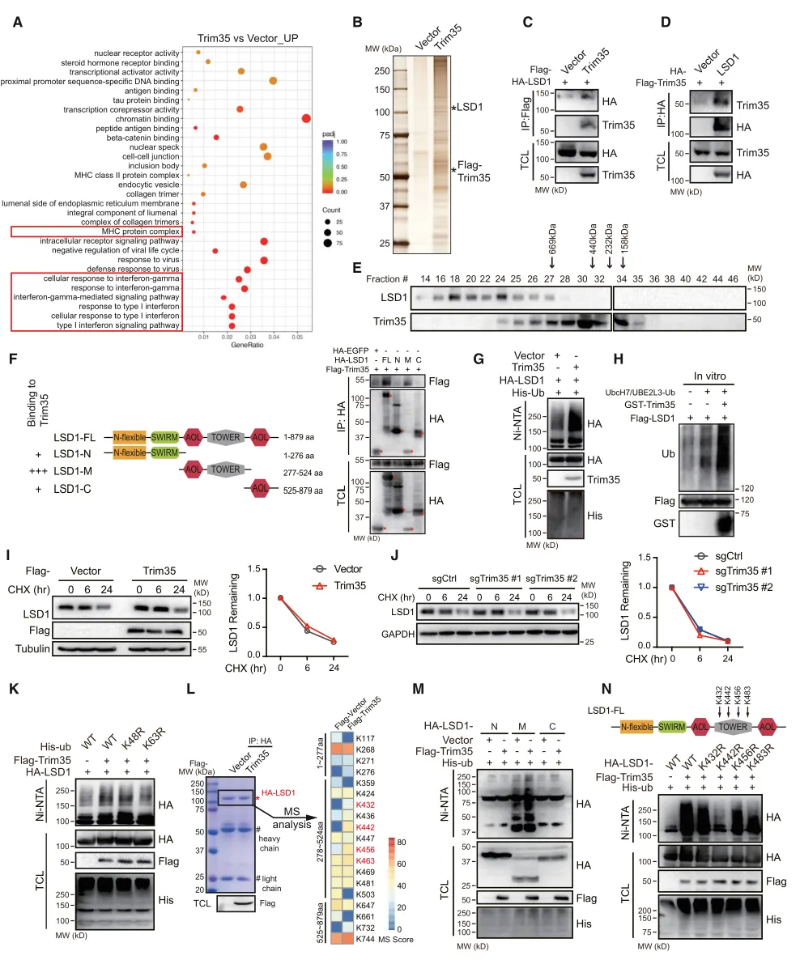 图3 Trim35靶向LSD1在K442位点上进行K63泛素化
图3 Trim35靶向LSD1在K442位点上进行K63泛素化
Trim35介导的泛素化抑制LSD1去甲基化酶活性
为了进一步研究Trim35介导的LSD1泛素化是否调节LSD1的去甲基化酶活性,作者检测了CoREST复合物的形成。结果发现过表达Trim35阻止了LSD1与RCOR1和HDACs的结合(RCOR1和HDACs是CoREST的核心成分),而LSD1 K442R突变体与RCOR1和HDACs的结合增加。通过体外组蛋白去甲基化酶活性测定发现,与LSD1 WT相比,过表达Trim35可以显著抑制LSD1的活性。接下来,作者使用两种常用的LSD1抑制剂(GSK2879552和ORY-1001)对6个NSCLC类器官进行了细胞活力测定,结果显示Trim35表达较低的类器官对LSD1抑制剂的敏感性较高,IC50值较低。这些结果表明Trim35诱导的LSD1 K63泛素化通过破坏CoREST复合物的形成而降低了LSD1的活性,且Trim35可作为一种生物标志物指导个体化LSD1靶向治疗。(图4)
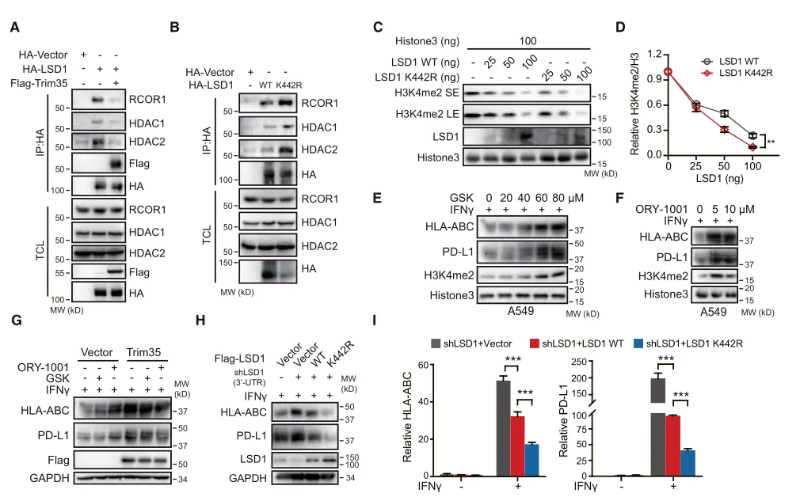 图4 K63连接LSD1泛素化抑制LSD1去甲基化酶活性
图4 K63连接LSD1泛素化抑制LSD1去甲基化酶活性
Trim35-LSD1轴介导IFN-g信号的潜在机制
作者通过全基因组CUT&Tag (Cleavage Under Target & Tagmentation)分析,鉴定出ERGIC1为Trim35过表达或LSD1抑制剂处理后LSD1结合减少的靶基因。通过染色质免疫沉淀和荧光素酶报告基因检测,结果显示Trim35过表达后ERGIC1转录水平显著升高,表明Trim35通过抑制LSD1介导的H3K4去甲基化上调ERGIC1。进一步的分析显示,在ERGIC1缺失的细胞中,细胞质和膜上IFNGR1水平急剧下降。氯喹(chloroquine, CQ)是一种有效的溶酶体和自噬抑制剂,逆转ERGIC1基因下调诱导的IFNGR1抑制,表明ERGIC1对IFNGR1自噬有抑制作用。综上所述,Trim35通过以LSD1依赖的方式促进ERGIC1的转录,增加MHC I类和PD-L1表达,抑制自噬以稳定IFNGR1并增强细胞对IFN-γ信号的反应。(图5)
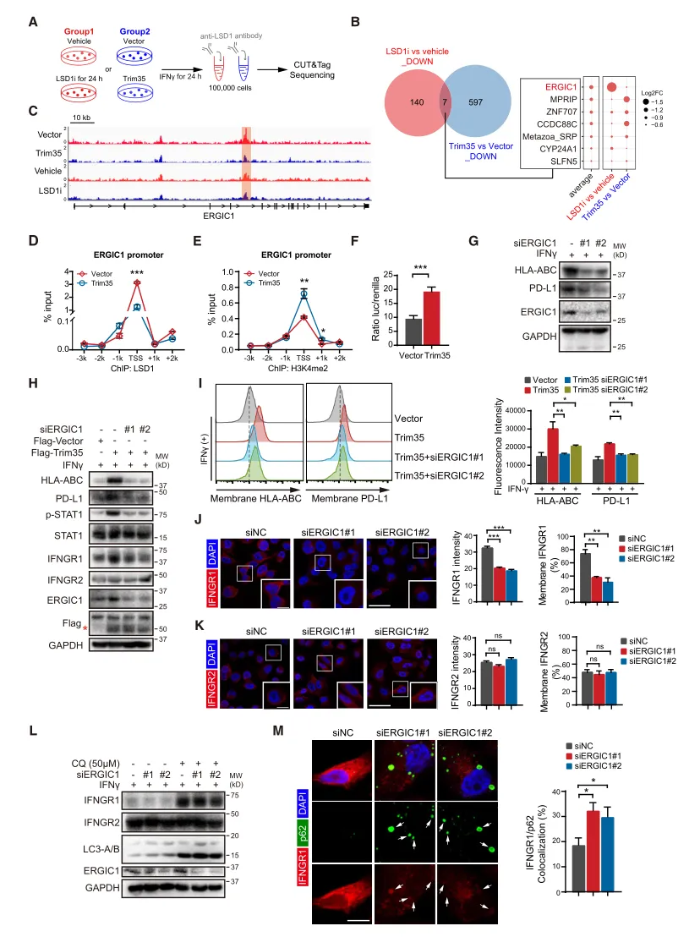 图5 Trim35-LSD1轴介导IFN-g信号的潜在机制
图5 Trim35-LSD1轴介导IFN-g信号的潜在机制
LSD1抑制与抗PD-1治疗Trim35低表达肺癌的协同作用
作者通过免疫组化染色检测了29例肿瘤样本(非小细胞肺癌接受抗PD-1治疗)中Trim35、LSD1、H3K4me2和PD-L1的水平,并通过优势比(OR)评估与免疫检查点阻断(ICB)治疗结果的相关性。作为非小细胞肺癌对ICB治疗反应的公认标志物,PD-L1的高表达与良好的治疗结果相关。核内Trim35水平与免疫治疗结果呈正相关,这与Trim35在体内外分别促进CD8+ T细胞浸润和膜PD-L1水平的观察结果一致。此外,与单独使用Trim35或PD-L1相比, 结合Trim35和PD-L1的水平对ICB治疗具有更强的预测能力。总而言之,Trim35可作为LSD1活性的潜在标志物预测肺癌的免疫治疗结果。(图6)
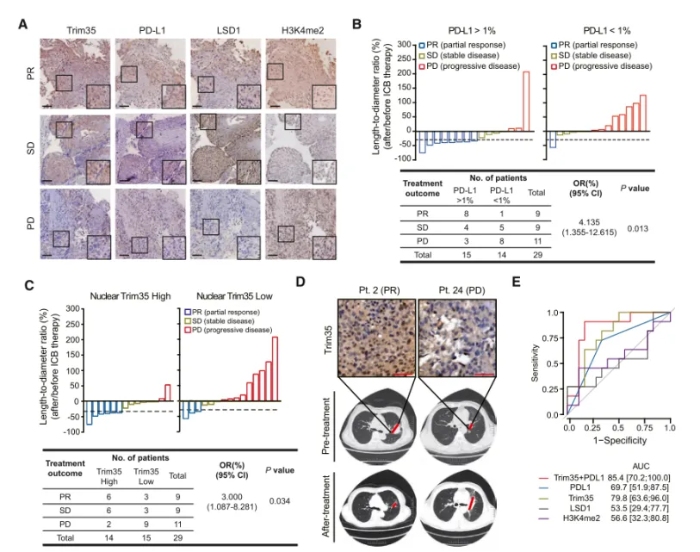 图6 Trim35是非小细胞肺癌患者PD-1阻断治疗的有力治疗标志物
图6 Trim35是非小细胞肺癌患者PD-1阻断治疗的有力治疗标志物
最后探究了低表达Trim35(高表达LSD1)的肿瘤是否可以通过抑制LSD1来致敏抗PD-1治疗。作者将WT或Trim35-KO LLC细胞接种到C57BL/6小鼠体内,并分别用PD-1单抗、LSD1抑制剂以及两者联合用药处理。由于LLC肿瘤具有较差的免疫原性,并且已知对PD-1阻断无反应,因此抗PD-1治疗对WT和Trim35-KO肿瘤均无影响。然而,LSD1抑制剂通过直接抑制肿瘤生长和提高CD8+ T细胞浸润,显著降低肿瘤体积,其中Trim35-KO肿瘤抑制效果更为明显。进一步探究发现PD -1单抗与LSD1抑制剂联合治疗可降低肿瘤生长,且这种效果在Trim35 KO肿瘤中更为显著。流式细胞术结果一致显示,LSD1抑制剂治疗的肿瘤中TIL浸润和MHC I类水平升高,而PD-1阻断进一步增加CD8+ T细胞的浸润活性,特别是在Trim35-KO肿瘤中。这些结果表明,Trim35表达水平可以作为使用LSD1抑制剂和PD-1单抗联合治疗肺癌的临床相关生物标志物。(图7)
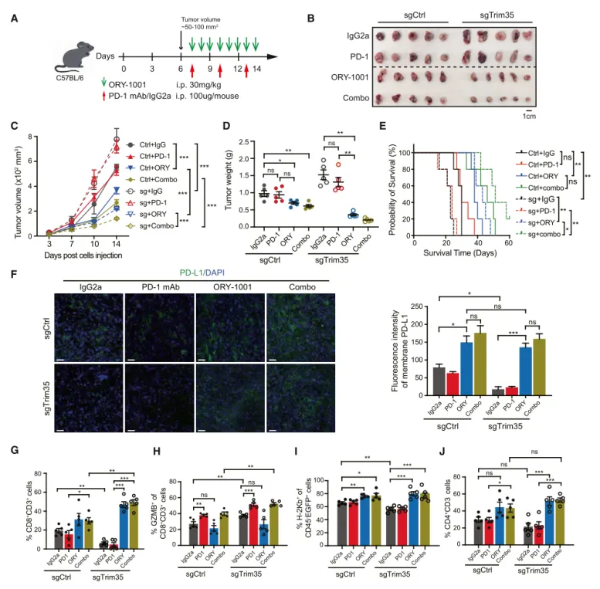 图7 LSD1抑制剂显著增强PD-1阻断在低Trim35表达NSCLC中的疗效
图7 LSD1抑制剂显著增强PD-1阻断在低Trim35表达NSCLC中的疗效
本研究揭示了Trim35作为一个E3连接酶参与了LSD1 K63泛素化的调控,导致对LSD1去甲基化酶活性的抑制。Trim35可以作为一个生物标志物评估LSD1的活性,并预测ICB疗法的预后。通过使用LSD1抑制剂,可以显著改善低表达Trim35的非小细胞肺癌的低免疫原性特征,提供了一种有前景的免疫治疗耐药肺癌的治疗策略。














