PDAC是人类最致命的实体恶性肿瘤,约90%的病例与PDAC有关。尽管治疗技术不断改进,但在过去的40年里,存活率的提高仍然有限,5年存活率低于9%。由于PDAC早期缺乏特异的临床症状、体征及有效的筛查标志物, 仅15%-20%的患者具备手术切除条件。因此, 以GEM为基础的单药或联合化疗仍是目前最主要的治疗方案。然而, PDAC对GEM的总反应率不足20%, 对GEM耐药是影响化疗疗效的最重要原因之一,目前GEM耐药的机制仍并不明确。
2022年10月,中国科学院昆明动物研究所赵博研究员、施鹏研究员团队,昆明医科大学附属第二医院朱洪教授团队以及苏州大学许国强教授团队携手在 Journal of Experimental & Clinical Cancer Research 上发表了题为 RETSAT associates with DDX39B to promote fork restarting and resistance to gemcitabine based chemotherapy in pancreatic ductal adenocarcinoma
该研究团队使用伯桢生物类器官传代消化液Organoid Dissociation Solution(E238001) 以及 肿瘤组织消化液Tumor Tissue Digestion Solution(K601003) 成功辅助构建了PDAC类器官,完成了全篇类器官相关实验。借助PDAC患者来源类器官,该研究团队有效证实了DDX39B在PDAC细胞中吉西他滨化疗抗性的影响,揭示了RETSAT通过与DDX39B相互作用在复制叉重启和基因组稳定中的关键角色。
为了研究RETSAT基因在PDAC中的作用,对比癌症基因组图谱(TCGA)数据发现,RETSAT在胰腺癌组织中的表达水平显著高于正常组织。随后,作者在三种细胞系中验证了RETSAT表达情况。作者发现RETSAT在未转化的人胰管上皮(HPDE)细胞系H6c7中未表现出显著的表达,而在两种已转化的PDAC细胞系BxPC-3和PANC-1中,RETSAT则表现出显著的高水平表达。与低表达组相比,RETSAT高表达组PDAC患者的总生存率明显较低(P = 0.027)。免疫组化分析进一步证实,RETSAT在PDAC组织中的表达显著高于相邻的非肿瘤组织(P = 0.0026)。此外,RETSAT低表达组的PDAC患者在吉西他滨化疗后的生存时间显著长于高表达组(P = 0.0002)。通过对临床样本进行综合分析后,作者发现低RETSAT水平的患者从吉西他滨治疗中获益更多。总之,这些发现支持了高RETSAT与PDAC患者低生存率相关。(图1)
图1 RETSAT的高表达与PDAC患者的低生存率相关
RETSAT缺失使PDAC细胞对吉西他滨诱导的凋亡敏感
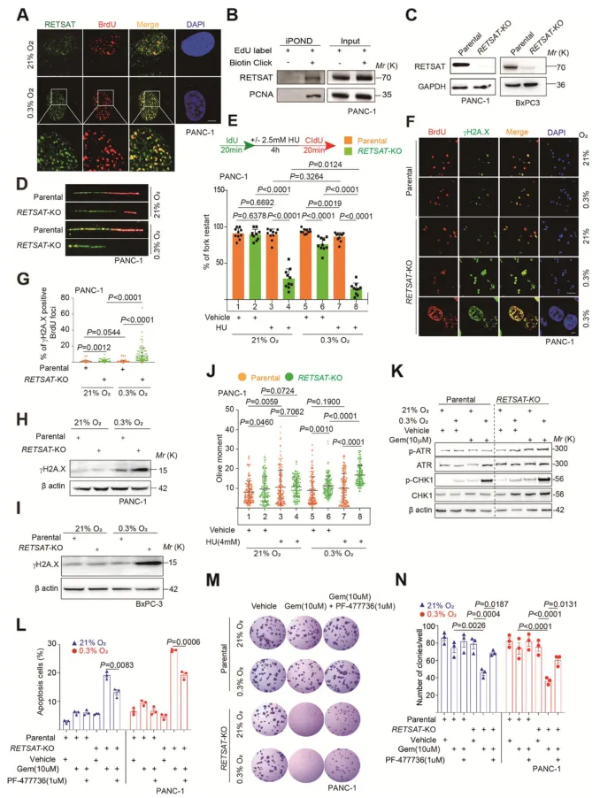
研究发现,RETSAT在PDAC细胞中的表达受HIF-1α信号调控,在低氧环境(0.3%氧气浓度)下显著上调。通过免疫荧光共染色实验,作者发现RETSAT在PDAC导管区域(高度缺氧区域)高表达,且HIF-1α阳性区域的RETSAT表达显著高于HIF-1α阴性区域。使用HIF-1α抑制剂PX-478处理PANC-1细胞后,RETSAT表达显著下降。利用CRISPR技术构建RETSAT敲除的PANC-1细胞在吉西他滨处理下的增殖显著减慢。RETSAT敲除细胞在吉西他滨和缺氧条件下表现出更高的凋亡率。在细胞衍生异种移植小鼠(CDX)模型中,RETSAT敲除的PANC-1细胞组在吉西他滨治疗后肿瘤体积明显减小、生存时间延长,显示出显著的肿瘤生长抑制效果。免疫荧光分析进一步显示,RETSAT缺失的CDX小鼠肿瘤中,中心和边缘区域的细胞增殖显著减少,而凋亡细胞显著增加。这些结果说明,RETSAT缺失通过增加吉西他滨诱导的细胞凋亡,显著增强了PDAC细胞对化疗的敏感性。(图2)
图2 RETSAT缺失使PDAC细胞对吉西他滨诱导的凋亡敏感
免疫荧光实验显示,RETSAT在PDAC定位在细胞核上,且与BrdU脉冲标记的DNA复制叉高度共定位。使用iPOND(新生DNA上蛋白质分离)实验验证RETSAT是复制叉结合蛋白。IdU 脉冲标记 PANC-1 细胞在吉西他滨处理过程后,通过中性彗星检测(检查双链 DNA 损伤)和 DNA 纤维检测(检查复制叉重启)发现,复制叉重启效率下降, DNA损伤水平急剧增加,表明复制叉重启缺陷可能导致DNA损伤积累。随后,作者通过CRISPR技术构建RETSAT敲除的PANC-1和BxPC-3细胞在DNA纤维实验中发现, RETSAT缺失的细胞在2.5 mM HU(羟基脲)处理下的复制叉重启效率显著降低。通过不同的短发夹 RNA分别靶向BLM和SMARCAL1(复制叉重启机械基因),PANC-1吉西他滨耐药(PANC-1/Gem-R)细胞系对吉西他滨诱导的细胞凋亡具有抗性,这说明复制叉重启对于PDAC细胞的吉西他滨的抗性至关重要。同时,在HU和缺氧条件下,RETSAT敲除细胞表现出更多的复制叉损伤和γH2A.X标记的DNA损伤。中性彗星实验及WB实验显示,RETSAT缺失细胞在吉西他滨处理后的DNA损伤显著增加,ATR-CHK1信号通路活性显著上升。当用 CHK1 拮抗剂 PF-4777361处理细胞后,RETSAT-KO 细胞凋亡被缓解。这些结果表明CHK1信号促进复制应激下RETSAT敲除PDAC细胞的凋亡,证实RETSAT促进复制叉重启和维持基因组稳定。(图3)
图3 RETSAT在复制压力下促进重新启动分叉
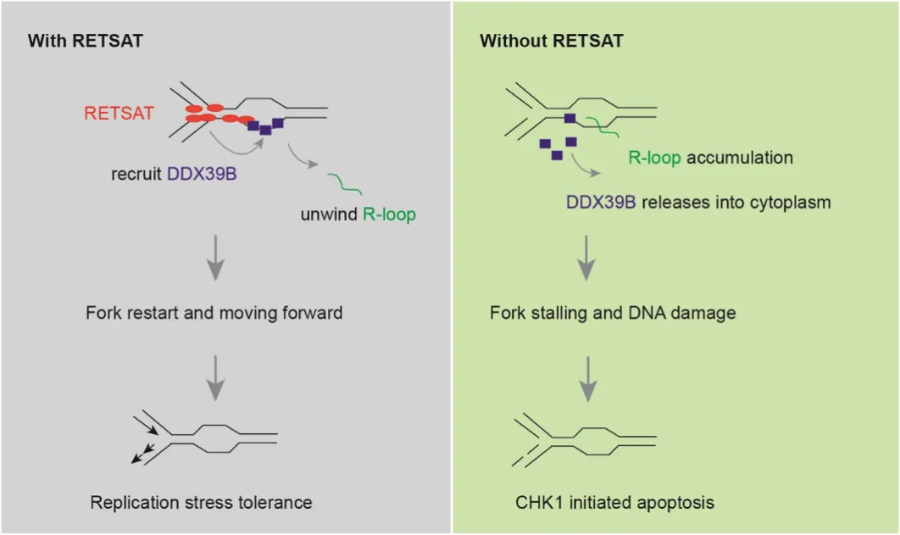
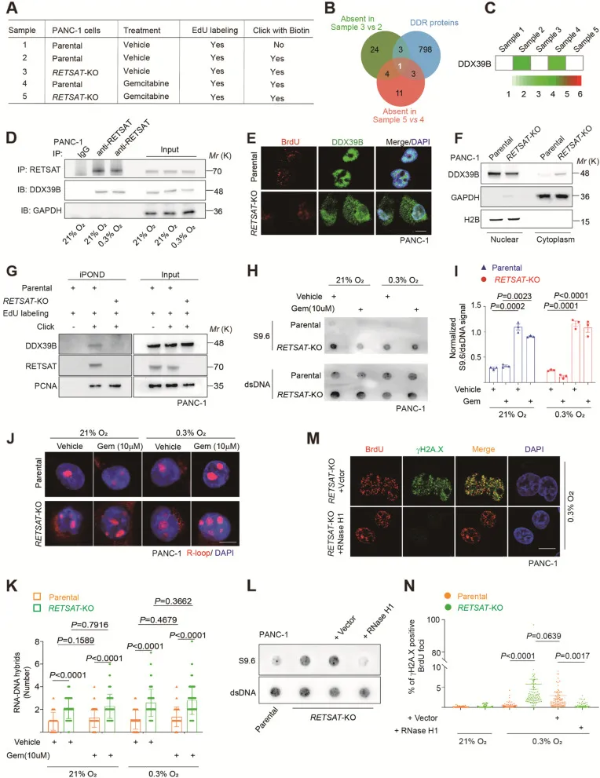
RETSAT招募DDX39B到复制叉上解旋R - loop
通过对亲代和RETSAT-KO PANC-1细胞进行了iPOND联合LC-MS/MS筛选,在正常培养条件下或吉西他滨诱导的复制压力条件下,作者对 RETSAT-KO 样本中缺失的蛋白质亚群进行了重叠。将筛选的蛋白与DNA损伤应答基因数据集重叠筛选出DDX39B。DDX39B(也称为UAP56或BAT1)是DEAD-box家族解旋酶,在mRNA的结合、剪接和翻译中起着关键作用。构建PANC-1/ Gem-R细胞中敲除DDX39B后,基于免疫共沉淀实验,发现RETSAT与R-loop解旋酶DDX39B相互作用。使用S9.6抗体进行R - loop点印迹验和免疫荧光证RETSAT- KO细胞中的复制叉重新启动缺陷是由R - loop积累引起的。综上,RETSAT负责将DDX39B招募到复制叉上,从而解决了R - loop障碍,维持了复制叉的稳定性。(图4)
图4 RETSAT招募DDX39B到复制分叉上解旋R - loop
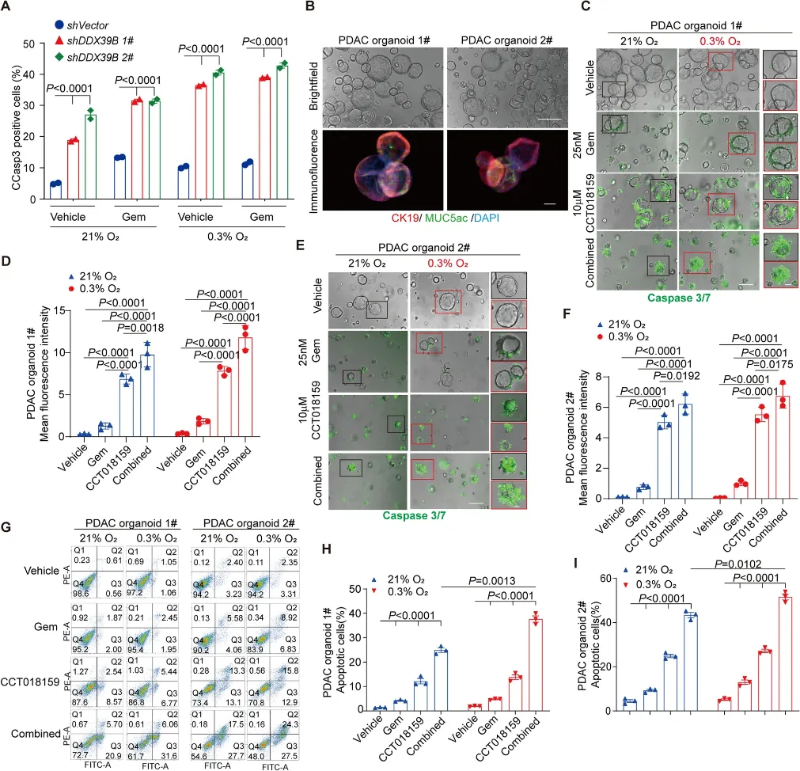
DDX39B抑制剂CCT018159与吉西他滨在人PDAC类器官系统中的协同作用评价
在21%或0.3%氧气浓度下,敲除DDX39B表现出凋亡表型,突出了RETSAT和DDX39B是PDAC化疗的潜在药物靶点。利用两种PDAC患者来源的类器官模型,作者发现CCT018159(可抑制DDX39B的ATP酶活性)处理PDAC类器官后,在两种氧气浓度下显著提高了类器官中细胞凋亡率,效果均优于吉西他滨,并且CCT018159与吉西他滨联合治疗显示出显著的协同效应。(图5)
图5 DDX39B抑制剂CCT018159与吉西他滨在人PDAC类器官系统中的协同作用评价
这项研究揭示了RETSAT在胰腺导管腺癌(PDAC)中的关键作用,发现其高表达与预后较差和吉西他滨化疗耐药相关。RETSAT被HIF-1α信号调控,在缺氧环境中促进复制叉重启,维持基因组稳定,并通过与DDX39B蛋白相互作用,清除R-loop,避免复制叉损伤和细胞凋亡,赋予PDAC细胞对吉西他滨的化疗抗性。这项研究为PDAC的治疗提供了新的潜在靶点。