肠道微生物群是一个复杂的微生物生态系统,由约1000种不同的微生物组成,它们通过代谢活动深刻影响着宿主的生理功能。近年来,随着对肠道微生物群与宿主健康之间相互作用认识的加深,人们开始意识到这些微生物产生的代谢产物在调节宿主生理过程中的重要作用。
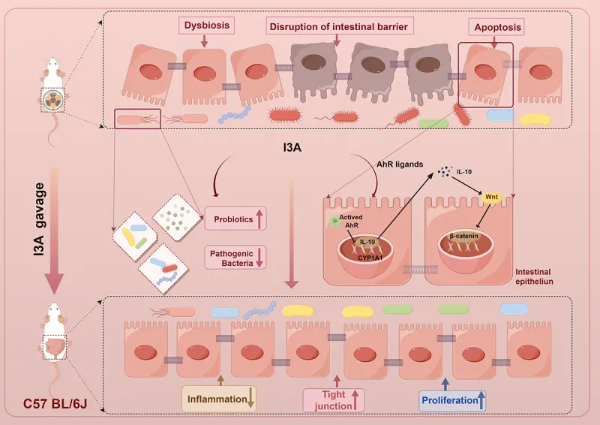
放射性肠病(RIE)是由癌症放射治疗过程中由辐射引起的一系列肠道损伤和肠道干细胞丢失的疾病。尽管已经有一些临床干预措施,如药物治疗、益生菌治疗和外科手术,但目前对于RIE的治疗仍未取得令人满意的效果。吲哚-3-甲醛(I3A)被认为是芳烃受体(AhR)的配体,是一种配体激活的转录因子,现已被证明与免疫调节、维持肠道屏障稳态、微生物共生等有关。最近的研究发现,I3A促进造血干细胞以改善辐射(IR)诱导的造血损伤。然而,I3A是否能在RIE小鼠模型中发挥肠道辐射保护作用尚不清楚,基于此作者展开了进一步探究。
2024年5月5日,苏州大学放射医学与防护学院李明副教授团队和苏州大学第二附属医院放射肿瘤科田野教授团队携手在 Gut Microbes 期刊上在线发表题为“ Microbiota-derived I3A protects the intestine against radiation injury by activating AhR/IL-10/Wnt signaling and enhancing the abundance of probiotics ”的研究论文。该研究发现I3A可以促进肠道上皮细胞增殖,上调益生菌的丰度,从而治疗放射性肠病。
研究团队使用伯桢生物的结直肠癌类器官(无血清)试剂盒Colorectal Cancer Organoid Kit(Serum-free)(K2103-CR)、肿瘤类器官(无血清)基础培养基Cancer Organoid Basal Medium(Serum-free)(B213152)、类器官传代消化液Organoid Dissociation Solution(E238001),成功构建了结直肠癌类器官并完成了I3A对辐射后肿瘤类器官的影响等一系列体外验证实验。基于结直肠癌类器官模型,作者发现辐照组与辐照+I3A处理组结直肠癌类器官生长并无差异,结果表明添加I3A在放疗期间并无对肿瘤的保护作用。
I3A保护肠隐窝类器官和HIEC-6细胞免受辐射损伤
为了筛选最有效的抗辐射吲哚衍生物,作者在小鼠肠道类器官水平上测试了包括IAA、I3A在内的6种初级吲哚衍生物。与对照组相比,发现I3A显著提高了辐照后肠道类器官的出芽率、生存率和表面积,减少了类器官损伤,这表明I3A对肠道干细胞(ISCs)具有保护作用。同时作者在细胞层面上采用结晶紫克隆存活实验证明I3A以剂量依赖的方式促进了受辐照的人肠细胞系HIEC-6的增殖,且100 μM I3A显示出最显著的辐射防护作用。这些结果均表明,I3A给药可以防止体外辐射诱导的肠道上皮细胞损伤(图1)
图1 I3A保护肠隐窝类器官和HIEC-6细胞免受辐射损伤
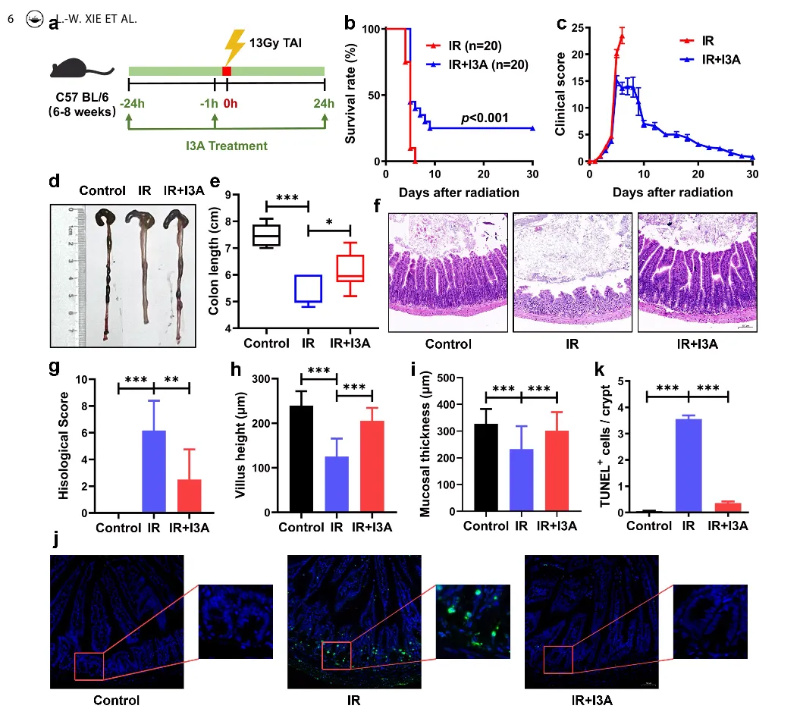
作者建立了小鼠RIE模型,通过口服I3A的方式观察到I3A处理的小鼠在接受13 Gy的全腹部照射(TAI)后生存率提高25%,临床评分降低,病理分析显示补充I3A显著降低了损伤评分,恢复了辐射引起的肠绒毛和粘膜的缩短等病理特征,这些结果进一步证实了I3A的体内放射保护效果。(图2)
图2 口服I3A可改善小鼠全腹照射导致的肠损伤
I3A促进隐窝细胞的增殖和分化并维持TAI后肠道屏障的完整性
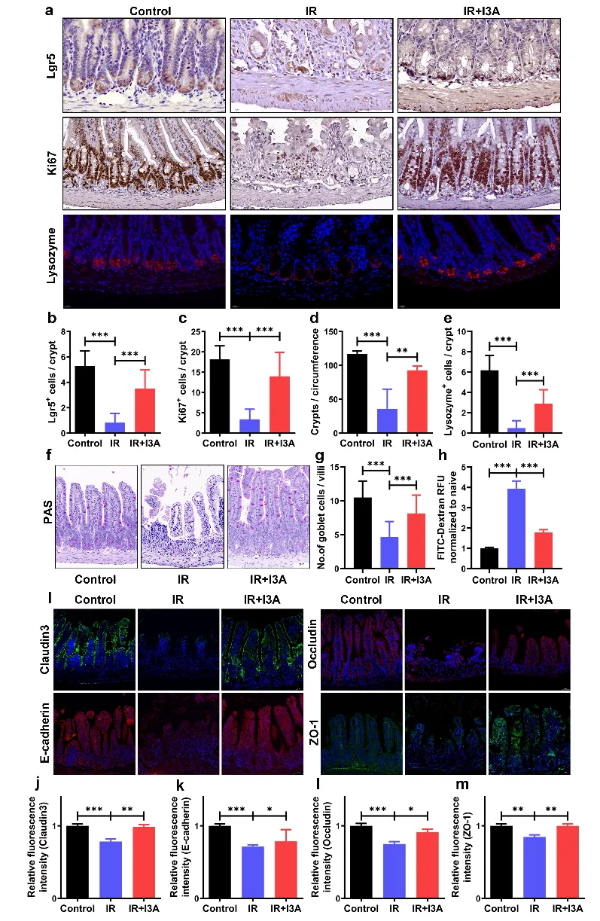
为了进一步评估I3A对肠道结构及功能的保护,作者检测了隐窝上皮细胞的增殖分化能力和肠道屏障功能。通过Lgr5、Ki67、Lysozyme等标志物的免疫组化染色及PAS染色发现I3A处理后有效保留了小肠隐窝-绒毛的正常结构,刺激肠道干细胞增殖、分化为潘氏细胞和杯状细胞,并通过E-Cadherin、ZO-1等膜蛋白的免疫荧光染色说明I3A处理能够维持肠粘膜屏障的完整性。(图3)
图3 I3A促进隐窝细胞的增殖和分化并维持TAI后肠道屏障的完整性
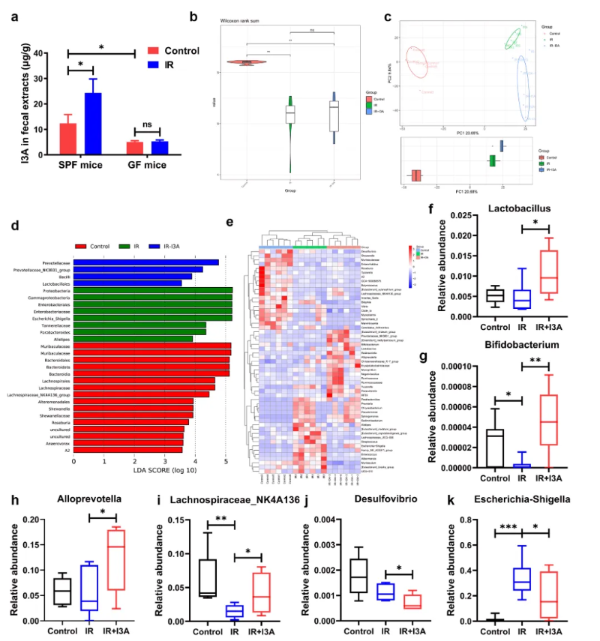
为了研究IR和肠道微生物群对I3A的影响,作者收集了无特异病原体(SPF)小鼠和无菌(GF)小鼠IR后的粪便进行高效液相色谱(HPLC)检测,结果发现SPF小鼠辐射后粪便中I3A含量显著增加,而无菌小鼠无变化,表明IR诱导的I3A产生取决于肠道微生物群。菌群测序结果显示I3A处理后肠道菌群结构发生显著改变。在属水平上,对人类健康有益而广为人知的乳杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)、 普雷沃氏菌(Alloprevotella) 和毛螺菌(Lachnospiraceae_NK4A136)的相对丰度在用I3A治疗的受照射小鼠中得到了富集。相反,I3A治疗降低了致病菌的相对丰度,如脱硫弧菌(Desulfovibrio)、 大肠杆菌-痢疾杆菌(Escherichia-Shigella)。这些结果表明I3A可以改善肠道环境,促进益生菌繁殖。(图4)
图4 肠道微生物群来源的I3A改变辐射诱导的肠道细菌结构
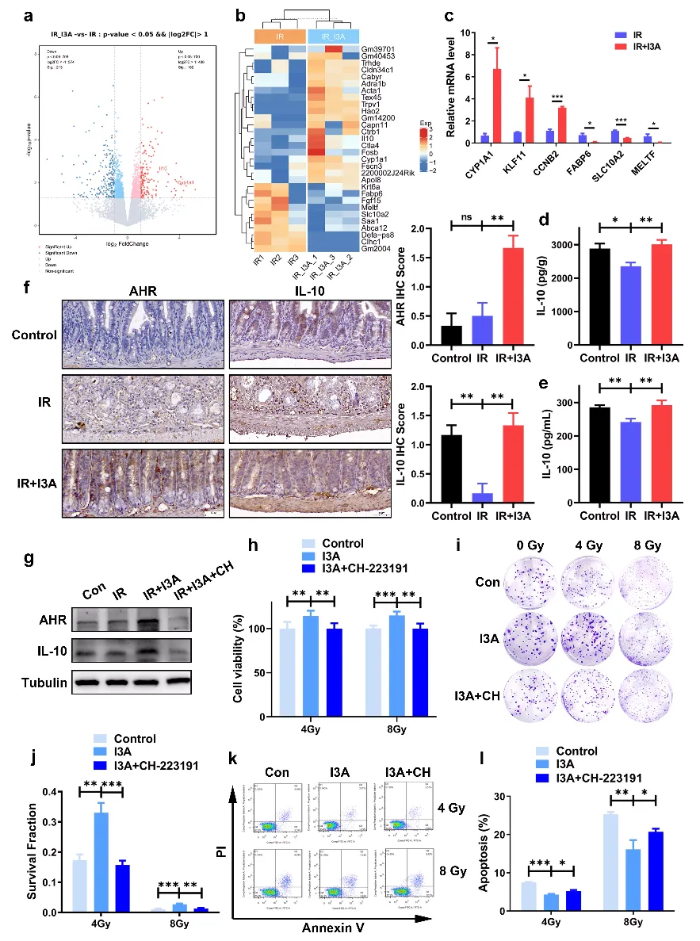
为了进一步了解I3A介导辐射防护的潜在机制,作者通过不同组别小肠进行转录组学分析联合q-PCR检测,对前30个上调和下调的基因进行了文献调研,以筛选与辐射诱导损伤相关的基因,最终发现I3A处理显著提高了AhR和IL-10的表达水平。为了进一步明确AhR在调节I3A辐射防护中发挥的作用,作者使用了AhR的强效特异性拮抗剂CH-223191来抑制AhR的核转位和DNA结合。Western blot分析显示,CH-223191有效抑制了HIEC-6细胞中AhR/IL-10的表达。CCK-8和克隆存活试验表明,CH-223191几乎完全消除了HIEC-6细胞中I3A介导的辐射防护作用。以上结果表明I3A对RIE的防护作用取决于AhR/IL-10信号传导。(图5)
图5 I3A的保护作用依赖于AhR/IL-10
I3A通过AhR/IL-10/Wnt3调控ISCs的增殖和分化
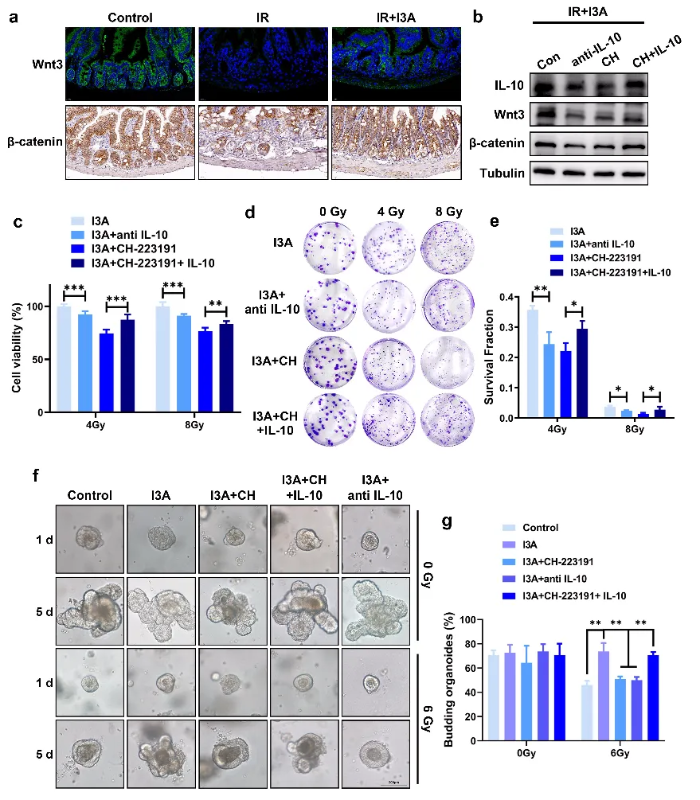
接下来,为了明确AhR/IL-10对肠道保护的具体机制,作者分析了与肠上皮自我更新、稳态和修复密切相关的Wnt/β-catenin信号通路。与受辐照的小鼠相比,接受I3A的小鼠显示Wnt3和β-catenin阳性细胞显著增加。Western blot分析进一步表明,I3A刺激导致Wnt3/β-catenin信号激活依赖于受辐照的HIEC-6细胞中的IL-10。同时CCK-8和克隆存活试验表明,补充IL-10可以抵消AhR抑制剂CH-223191对HIEC-6细胞中I3A介导的辐射防护的抑制作用。为了进一步确定I3A对辐射诱导的肠道损伤和相关机制的影响,作者再次在小鼠肠道类器官水平上进行验证,由Wnt/β-catenin信号控制的增殖状态,主要表现为图6f所示的类器官出芽现象。相较于辐照组添加I3A可显著提高类器官出芽率,并通过添加CH-223191、IL-10发现CH-223191的添加可显著抑制I3A治疗组的类器官出芽率,而IL-10的额外添加则可缓解此抑制作用,再次验证I3A对RIE的防护作用取决于AhR/IL-10信号传导。以上结果均证实了I3A以AhR/IL-10/Wnt3/β-catenin通路依赖的方式促进了肠上皮细胞的损伤修复。(图6)
图6 I3A通过AhR/IL-10/Wnt3调控ISCs的增殖和分化
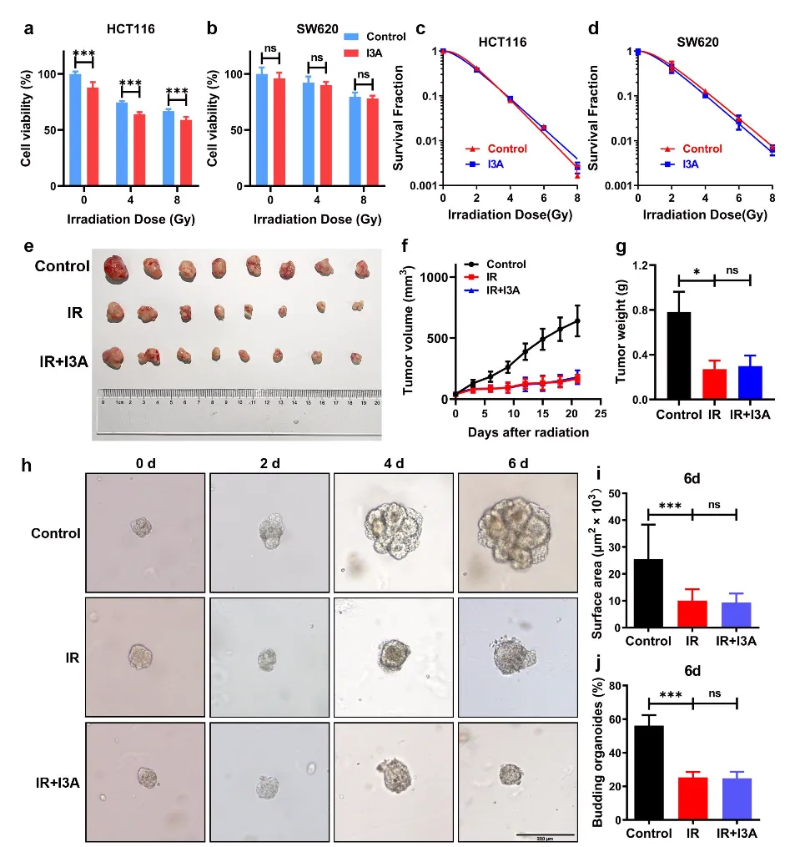
最后,为了确保I3A不会影响恶性肿瘤接受放疗杀伤,作者采用结肠癌细胞系与结直肠癌类器官进行验证。结果显示,I3A处理的结肠癌细胞和结直肠癌类器官没有辐射保护作用,同时在结直肠癌异种移植小鼠模型中发现IR组和IR+I3A组之间异位肿瘤的生长没有显著差异。这些结果表明,I3A在放疗期间对肿瘤没有保护作用。(图7)
图7 I3A不会保护肿瘤组织免受辐射伤害
在本项研究中,研究团队采用的多层面实验方法,包括肠道类器官培养、动物模型建立、微生物组分析和分子层面的验证,有力的证明了I3A可以有效改善化疗辐射后的肠道损伤,同时发现了其具体作用机制是增强益生菌丰度,激活AhR/IL-10/Wnt信号通路促进肠上皮细胞增殖。本研究为RIE背景下微生物衍生代谢物的功能和潜在保护机制提供了新的见解,对于开发新的放射防护策略具有重要的临床应用潜力,尤其是在提高放射治疗的安全性和有效性方面。